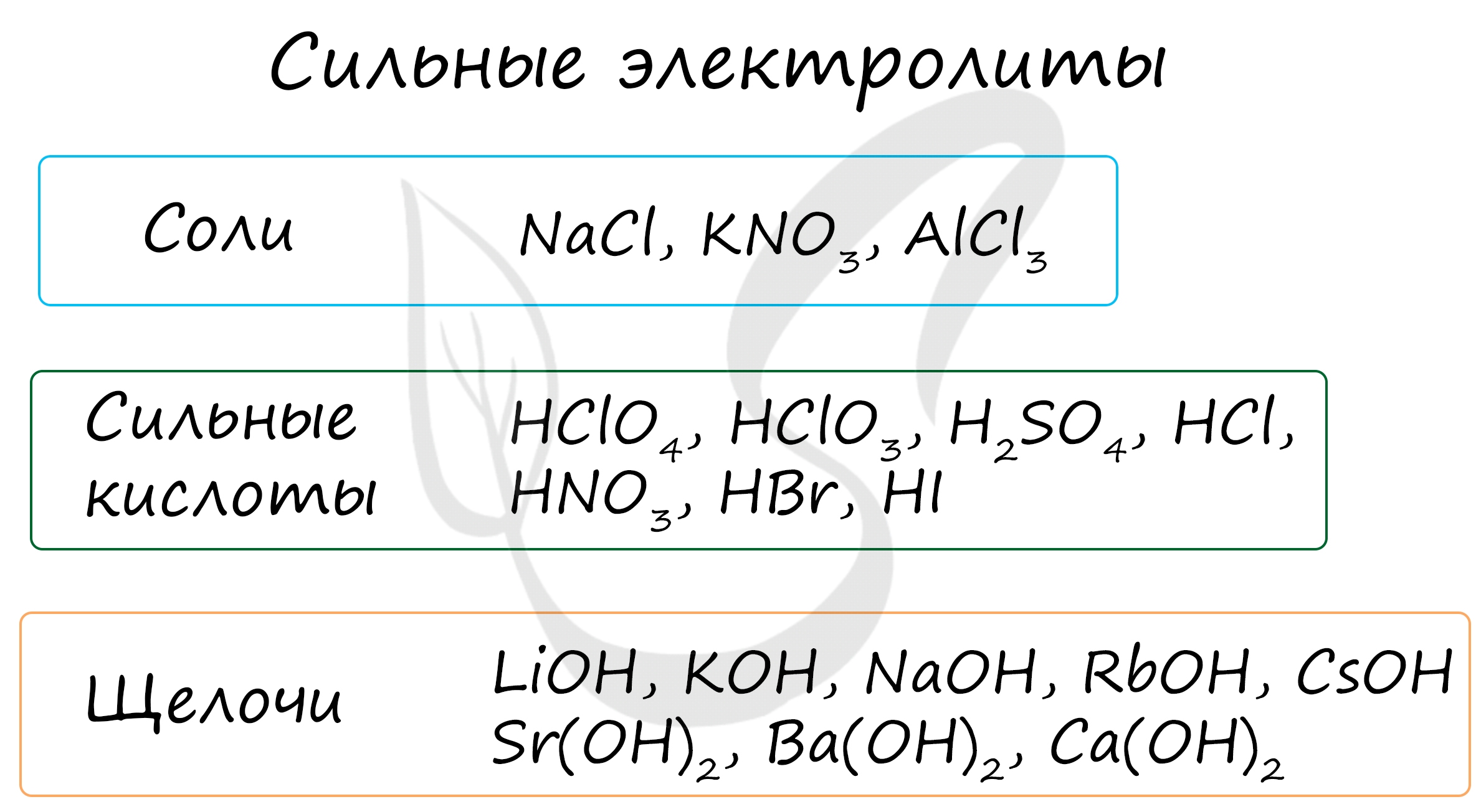
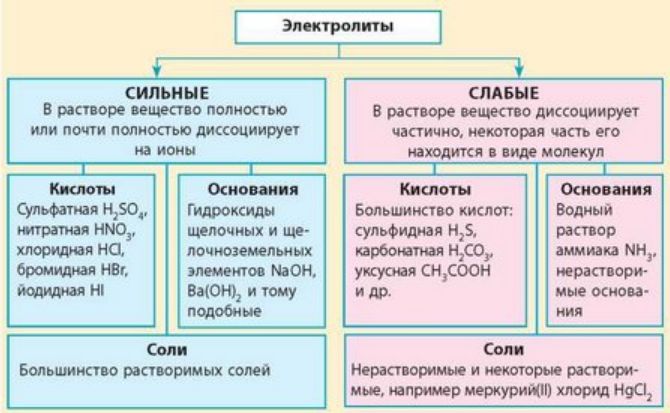
Сильный электролит это, Электролиты и неэлектролиты

Какую массу этой соли использовали для приготовления такого раствора? Расчет коэффициентов активности. Состояние сильных электролитов в растворе. В оксигенсодержащих кислотах при диссоциации разрывается связь O-H, полярность которой зависит от качественного и количественного состава кислотного остатка. Для реакций в растворах при участии ионов составляют не только молекулярное уравнение , но также полное ионное и краткое ионное.
По значению степени электролитической диссоциации электролиты часто разделяют не на две, а на три группы: сильные, слабые и электролиты средней силы. Две последние кислоты являются электролитами средней силы только по первой стадии диссоциации, а по другим — это слабые электролиты. Степень диссоциации — величина переменная. Она зависит не только от природы электролита, но и от его концентрации в растворе. Эту зависимость впервые определил и исследовал Вильгельм Оствальд.
Сегодня ее называют законом разведения Оствальда: при разбавлении раствора водой, а также при повышении температуры степень диссоциации увеличивается. В одном литре воды растворили гидроген флуорид количеством вещества 5 моль.
Полученный раствор содержит 0,06 моль ионов Гидрогена. Определите степень диссоциации флуоридной кислоты в процентах. При диссоциации из одной молекулы кислоты образуется один ион Гидрогена.
Следовательно, степень диссоциации равна:. Выдающийся немецкий физико-химик, лауреат Нобелевской премии по химии года. Родился в Риге, учился в Дерптском университете, где начал преподавательскую и научную деятельность. В 35 лет переехал в Лейпциг, где возглавил Физико-химический институт. Изучал законы химического равновесия, свойства растворов, открыл закон разведения, названный его именем, разработал основы теории кислотно-основного катализа, много времени уделял истории химии.
Основал первую в мире кафедру физической химии и первый физико-химический журнал. В личной жизни обладал странными привычками: чувствовал отвращение к стрижке, а со своим секретарем общался исключительно при помощи велосипедного звонка. Диссоциация слабых электролитов — обратимый процесс, а сильных —. Какую величину используют для количественной характеристики силы электролита?
Является ли она постоянной в любых растворах? Как можно увеличить степень диссоциации электролита? Приведите по одному примеру соли, кислоты и основания, которые являются: а сильным электролитом; б слабым электролитом. Приведите пример вещества: а двухосновная кислота, которая по первой стадии является электролитом средней силы, а по второй — слабым электролитом; б двухосновная кислота, которая по обеим стадиями является слабым электролитом.
Какая кислота это может быть? Из приведенного перечня веществ отдельно выпишите формулы: а сильных электролитов; б слабых электролитов.
Как можно видеть, заряженные частицы, которые могли бы быть обеспечивать электрическую проводимость присутствуют, но статичны, то есть неподвижны в узлах решетки. Поэтому, чтобы электрический ток смог протекать через хлорид натрия, нужно еще и обеспечить «подвижность» ионов, из которых он состоит. Как известно, для одного и того же вещества наиболее подвижны составляющие его частицы в том случае, когда он находится в жидком, а не в твердом агрегатном состоянии.
Поэтому для того, чтобы хлорид натрия смог проводить электрический ток, его необходимо расплавить, то есть превратить в жидкость. Однако, добиться диссоциации хлорида натрия можно не только его плавлением, но также и его растворением в воде. Но каким образом, это становится возможным? Ведь для того чтобы произошло разрушение кристаллической решетки требуется сообщить ей энергию, что и происходило при расплавлении. Откуда же берется энергия на разрушение решетки в случае растворения?
При помещении кристалла NaCl в воду его поверхность подвергается «облепливанию» молекулами воды или гидратации , в результате которой, ионам в структурной решетке сообщается энергия, достаточная для выделения из структурной решетки и «отправления в свободное плавание» в «оболочке» из молекул воды:.
Если энергия, выделяющаяся при гидратации кристалла, меньше энергии кристаллической решетки, то его растворение и диссоциация становятся невозможными. Помимо веществ ионного строения, электролитически диссоциировать способны также и некоторые вещества молекулярного строения с ковалентным полярным типом связи, а именно кислоты. Как и в случае ионных соединений, причина образования ионов из электронейтральных молекул кроется в их гидратации.
Существование гидратированных ионов энергетически более выгодно, чем существование гидратированных молекул. Например, диссоциация молекулы соляной кислоты выглядит примерно следующим образом:. Таким образом, уравнение диссоциации соляной кислоты правильнее записывать так:.
Тем не менее, даже в этом случае, чаще всего, уравнение диссоциации соляной кислоты, впрочем, как и любой другой, записывают, игнорируя явное участие в диссоциации кислот молекул воды. Степень диссоциации — отношение числа продиссоциировавших частиц, к общему числу растворенных частиц.

Вещества, которые не являются ни кислотами, ни солями, ни гидроксидами, считаются неэлектролитами. К неэлектролитам, например, относятся простые вещества, оксиды, органические вещества спирты, углеводороды, углеводы, хлорпроизводные углеводородов и т. Сильные электролиты диссоциируют практически необратимо и в их водных растворах содержание исходных молекул крайне мало:. Добрый день! Подскажите, пожалуйста, считаются ли малорастворимые соли например MgSO3 и нерастворимые соли и основания например BaSO4 слабыми электролитами?
Тут смотрите какое дело. Есть два взгляда на этот вопрос. Что такое сильный электролит? Речи о плохой или хорошей растворимости не идет. С этой точки зрения сильными электролитами являются практически все соли, даже нерастворимые, за исключением некоторых солей ртути. За стандартное состояние для сильного электролита в растворе выбирают гипотетический раствор со средней концентрацией ионов электролита, равной единице, и со свойствами предельно разбавленного раствора 2-е стандартное состояние :.
На рисунке VII. Средний коэффициент активности разбавленного электролита можно оценить при помощи правила ионной силы. Ионная сила I растворасильного электролита или смеси сильных электролитов определяется уравнением:. Согласно правилу ионной силы в разбавленных растворах средний коэффициент активности электролита зависит только от ионной силы раствора.
Характеристики природных и технических вод. Определение стабильности водных сред. Причины и условия отложения неорганических солей.
Термодинамическая и электростатическая теория растворов электролитов. Коррозионные среды Характеристики природных и технических вод Контроль качества воды Определение стабильности водных сред Причины и условия отложения неорганических солей Теория активных столкновений Термодинамическая и электростатическая теория растворов электролитов.