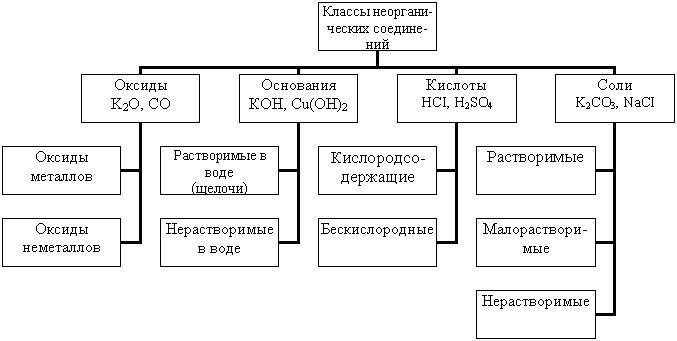
Основные классы неорганических соединений таблица, Классификация неорганических веществ, основные классы и номенклатура с примерами в таблице

Это действительно так, поскольку Н3РО2 — кислота одноосновная. Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» задание 5 ЕГЭ по химии с ответами Химические вещества можно разделить на две группы: простые и сложные. Нерастворимые в воде кислоты : H 2 SiO 3 и другие. Однако одному элементу может соответствовать несколько простых веществ. Сайты образовательных учреждений Сайты коллег Форумы.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. Двойные оксиды — это некоторые оксиды, образованные элементом с разными степенями окисления. Алгоритм определения типа оксида: сначала определяем, какой элемент образует оксид — металл или неметалл. Если это металл, то определяем степень окисления, затем определяем тип оксида. Если это неметалл, то оксид кислотный если это не исключение. Гидроксиды — это сложные вещества, в составе которых есть группа Э-O-H.
К гидроксидам относятся основания, амфотерные гидроксиды, и кислородсодержащие кислоты. Например , оксид хрома II CrO — основный, ему соответствует гидроксид основание. Так получаем мета-формулу кислоты. Если мы добавим еще одну молекулу воды, то получим орто-формулу кислоты.
Добавляем воду, орто-форма: H 3 PO 4. Орто-форма устойчива у фосфора и мышьяка. Основания основные гидроксиды — это сложные вещества, которые при диссоциации в водных растворах в качестве анионов отрицательных ионов образуют только гидроксид-ионы OH —. Основания можно разделить на растворимые в воде щелочи , нерастворимые в воде, и разлагающиеся в воде. К разлагающимся в воде неустойчивым основаниям относят гидроксид аммония, гидроксид серебра I , гидроксид меди I.
В водном растворе такие соединения практически необратимо распадаются:. По содержанию атомов кислорода кислоты бывают бескислородные например , соляная кислота HCl и кислородсодержащие например , серная кислота H 2 SO 4.
Определить, сильная кислота перед вами, или слабая, позволяет простой прием. Мы вычитаем из числа атомов O в кислоте число атомов H.
Если получаем число 2 или 3, то кислота сильная. Если 1 или 0 — то кислота слабая. Также солями называют вещества, которые могут быть получены при взаимодействии кислот и оснований с выделением воды. Если рассматривать соли, как продукты взаимодействия кислоты и основания , то соли делят на средние , кислые и основные. Средние соли — продукты полного замещения катионов водорода в кислоте на катионы металла например , Na 2 CO 3 , K 3 PO 4.
Основные соли — продукты неполного замещения гидроксогрупп основания на анионы кислотных остатков кислоты например , малахит CuOH 2 CO 3. Простые соли — состоящие из катиона одного типа и аниона одного типа например , хлорид кальция CaCl 2. Двойные соли — это соли, состоящие из двух или более разных катионов и аниона одного типа например , алюмокалиевые квасцы — KAl SO 4 2.
Смешанные соли — это соли, состоящие из катиона одного типа и двух или более анионов разного типа например , хлорид-гипохлорит кальция Ca OCl Cl. По структурным особенностям выделяют также гидратные соли и комплексные соли.
Например , бинарные соединения элементов с водородом. Водородные соединения — это сложные вещества, состоящие из двух элементов, один из которых водород.
Водород образует солеобразные гидриды и летучие водородные соединения. Степень окисления водорода равна Например , гидрид натрия NaH. Например , аммиак NH 3 , фосфин PH 3. Тренировочный тест «Классификация неорганических веществ» 10 вопросов, при каждом прохождении новые.
Среди предложенных формул веществ, расположенных в пронумерованных ячейках, выберите формулы:. Запишите в таблицу номера ячеек, в которых расположены вещества, под соответствующими буквами. Запишите в таблицу номера ячеек, в которых расположены выбранные вещества, под соответствующими буквами.
В соли. В кислотного оксида. Среди предложенных формул и названий веществ, расположенных в пронумерованных ячейках, выберите формулу или название, соответствующее.
В кислой соли. Перезапустить викторину. Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев. RU — При поддержке WordPress.
Классификация неорганических веществ. Тренировочные тесты в формате ЕГЭ по теме «Классификация неорганических веществ» задание 5 ЕГЭ по химии с ответами Химические вещества можно разделить на две группы: простые и сложные. Простые вещества можно разделить на металлы и неметаллы. Встречаются и оксиды, похожие на соли, то есть солеобразные двойные. Солеобразующим оксидам соответствуют гидроксиды: основному оксиду соответствует гидроксид основание , кислотному оксиду соответствует гидроксид кислота , амфотерному оксиду соответствует амфотерный гидроксид.
Если все индексы кратны 2, то мы делим все индексы на 2. Твёрдые неметаллы, как правило, не обладают характерными для металлов блеском, хрупки, очень плохо проводят электрический ток и теплоту. Некоторые простые вещества по внешнему виду напоминают металлы например, имеют металлический блеск , а по некоторым свойствам хрупкость, плохая теплопроводность — неметаллы.
Их иногда называют металлоидами. Часто они являются полупроводниками. К числу металлоидов относят галлий, германий, мышьяк, сурьму, селен, теллур. Среди сложных веществ можно выделить неорганические и органические вещества.

В состав органических веществ обязательно входит углерод. Если элемент образует несколько оксидов, то после названия элемента в скобках римской цифрой указывается численное значение его степени окисления:.
Основные оксиды образуют только металлы. Основным оксидам соответствуют основания. Кислотные оксиды могут быть образованы как неметаллами, так и металлами, при этом атомы металлов, входящих в состав кислотных оксидов, имеют высокую степень окисления. Кислотным оксидам соответствуют кислоты.
Если металл образует несколько оксидов, в которых он проявляет разные степени окисления, то существует закономерность: с ростом степени окисления металла уменьшаются основные и увеличиваются кислотные свойства образуемых им оксидов. Названия основных гидроксидов составляются из слова «гидроксид» и русского названия элемента в родительном падеже с указанием его степени окисления римскими цифрами если это необходимо.
По функциональным признакам к важнейшим классам неорганических соединений относятся основания, кислоты и соли. По растворимости в воде : растворимые в воде и нерастворимые в воде.
В растворах щелочей концентрация гидроксид-ионов достаточно высока. Напомним, что абсолютно нерастворимых соединений нет. Поэтому при растворении и диссоциации нерастворимых оснований гидроксид-ионы тоже образуются, но их концентрация чрезвычайно мала и определяется растворимостью основания.
Присутствие образующихся гидроксид-ионов даже в очень небольших количествах определяет общие свойства оснований. Все основания гидроксиды металлов — твёрдые вещества. В таблице представлены состав и названия некоторых комплексных анионов, образующихся при взаимодействии амфотерных оксидов и гидроксидов с щелочами. Состав и названия анионов, образующихся при взаимодействии. Названия кислородсодержащих кислот также образуются от русского названия соответствующего элемента с добавлением «кислота».
С точки зрения теории электролитической диссоциации, соли — это соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов или ион аммония и отрицательно заряженные ионы кислотных остатков. Существуют также комплексные соли , содержащие комплексные ионы. Соли, образованные одним металлом и двумя кислотами, называются смешанными. Названия солей образуются от названия аниона в именительном падеже и названия катиона в родительном падеже.
Название аниона состоит из латинского корня наименования соответствующей кислоты, окончания, приставки если необходимо. Для названия катиона используют русское наименование соответствующего металла или группы атомов, в случае необходимости указывают степень окисления металла.
При наименовании солей кислородсодержащих кислот к латинскому корню названия элемента добавляется окончание — «-ат» для высших степеней окисления, «-ит» для более низких. При названии солей некоторых кислот используется приставка «гипо-» для низких степеней окисления неметалла; для солей хлорной и марганцовой кислот используется приставка «пер-».
Анионы бескислородных кислот называют по общему для бинарных соединений правилу, т. В таблице представлены формулы кислот, их названия и названия соответствующих солей. Названия кислот и анионов их солей. Тривиальные названия некоторых солей. Понятие кислоты и основания. Кислотно-основные взаимодействия чрезвычайно распространены в природе и находят широкое применение в научной и производственной практике. Теория кислот и оснований — совокупность фундаментальных физико-химических представлений, описывающих природу и свойства кислот и оснований.
Основания — сложные вещества-электролиты, диссоциирующие с образованием гидроксид-иона и катиона металла. Кислоты — это сложные вещества, которые в результате гетеролитического разрыва отдают частицу с положительным зарядом — протон водорода кислота Бренстэда. Основание — это химическое соединение, способное образовывать ковалентную связь с протоном основание Бренстеда. Кислота — молекула либо ион, имеющее вакантные электронные орбитали, являющееся акцептором электронной пары кислота Льюиса.
Основание — это химическое соединение, способное образовывать ковалентную связь с вакантной орбиталью другого химического соединения.
Групповые названия элементов, входящих в таблицу Менделеева. Для элементов, входящих в периодическую систему ПС элементов Д. Менделеева разрешено использовать следующие групповые названия, отражающие, как правило, общие свойства элементов и простых веществ.
Для элементов главных подгрупп в короткопериодном варианте ПС или и групп в длиннопериодном современном варианте ПС. Название простых веществ. Простые вещества называют, как правило, так же, как и соответствующие элементы. Свои собственные названия имеют только аллотропные модификации углерода алмаз, графит, карбин, фуллерены и вторая модификация кислорода озон. При названиях аллотропных модификаций остальных элементов обычно указывают её краткую физическую характеристику белый, красный, чёрный фосфор, кристаллическая и пластическая сера, серое и белое олово и т.
Название анионов. Степень окисления углерода в органических соединениях определяется специальными способами см. Названия некоторых стабильных анионов, состоящих из атомов более чем одного элемента, традиционно также имеют окончания -ид:.
Классификация и номенклатура солей.
- Таблица Культура Эпохи Возрождения 7 Класс
- Биография Льва Николаевича Толстого 3 Класс
- Сколько Живут Животные Таблица
- Основные Темы И Мотивы Лирики Лермонтова
- Таблица Определение Обстоятельство Дополнение
- Сообщение О Толстом 4 Класс Кратко
- Мифы Древней Греции 5 Класс Короткие
- Двоичная Система Счисления Таблица
- Таблица Роста И Веса Для Женщин
- Хронологическая Таблица Жизни Лермонтова